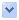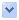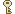自從虎克藉由光學鏡片觀察到植物細胞構造起,舉凡微生物學、植物學、動物學、醫學、地質學等之研究莫不因為光學顯微鏡之發明而進入一的新的境界,電子顯微鏡(Electrical Microscope),然而解像力(resolving power)達0.2μ的光學顯微鏡終究無法滿足研究需求,為突破此難關,電子顯微鏡相關理論與成品則應運而生。電子顯微鏡之相關理論起源自1920年代,穿透式電顯商品化起自1930年代;Knoll於1935年提出掃描式電顯原理,但遲至1964年掃描式電子顯微鏡才商品化。簡單的說來,光學顯微鏡以可見光為光源,經由光學透鏡組將影像放大;而電子顯微鏡則以「電子束」取代可見光源,以電磁透鏡取代光學透鏡。
電子顯微鏡可大略分為兩大類:穿透式電顯(Transmission Electron Microscope, TEM)與掃描式電顯(Scanning Electron Microscope, SEM),TEM接受穿透樣本的電子而呈像,多用於生物組織研究或病理研究;SEM則主要以反射自樣本表面之電子進行呈像;SEM的景深長,影像較能呈現立體感,樣本製作容易,可直接進行固體樣本表面觀察,廣泛應用於醫學、材料學、生物學、地質學等多方面。
【延伸閱讀】科學人雜誌網站~掃描式電顯的奈米世界
http://www.sciam.com.tw/circus/circusshow.asp?FDocNo=267&CL=9
圖1.HITACHI SEM S-2300
圖2.HITACHI SEM S-800
--------------------------------------------------------------------------------
掃描式電顯樣本之製備步驟
一般木材樣本製備步驟包括:軟化(保存)、切取試樣、固定、脫水、臨界點乾燥(Critical Point Drying, CPD)、金屬覆膜(Ion Coating)等步驟,其中軟化、保存、脫水、切片等步驟可參考光顯樣本之製備法,僅在此介紹固定、臨界點乾燥及金屬覆膜。
固定(Fixation):
「固定」的目的在於殺死並維持生物組織或細胞的真實與完整,以固定液處理生物細胞後,可以防止細胞在乾燥或其他處理時產生的收縮或膨脹變形、組織或胞器的溶解或其他非自然生成的現象(如細胞表面形成粒狀物質或形成平滑表面等),除此之外,部分固定液甚至可促進染色劑與組織的結合。
固定劑之種類
Formaldehyde:pH值不穩定,易趨酸性,固定效果不佳。
Paraformaldehyde:對組織保存性良好,不會造成細胞間隙擴大現象。
Glutaraldehyde:對組織的自然原質改變較少,不易與脂肪類產生作用,適合用於前固定處理,但其所得之對比較弱。一般使用濃度2.5~4%,固定時間2小時(或以上),緩衝溶液採用pH7.4之cacodylate buffer。
Acrolein (acrylic aldedyde):主要作用於C1及C2間之雙鍵,滲透性強,對染色質的保存效果特別良好,對於其他組織之保存效果與glutaraldehyde相似。一般使用濃度3~6%,以pH 7.3~7.5之Millonig’s buffer固定1~2小時。需使用Glycol methacrylate包埋。
Uranyl acetate:對膜狀結構的保存性最佳,可防止磷酸脂物(phospholipid)之流失,處理後組織之對比強,一般多用於醛類固定後之後固定與染色,一般使用濃度0.5%之水溶液,pH 3.9,固定時間20分鐘至2小時。
Osmium tetroxide:四氧化鋨能與蛋白質及不飽和脂肪作用,對細胞質與核的保存效果良好,由於其滲透性弱,若用於前固定時,易造成標本中心不完全固定,故多用於後固定。一般使用濃度多為1~2%,於4℃下固定1~2小時,以0.1M cacodylate buffer或phosphate buffer配置。由於此藥之毒性強(註1),故最好限於實驗室抽氣櫃中低溫下操作。
(註1) 蒸氣有毒!! 打開容器時需採取防護措施,過度接觸之可能症狀有流淚、視力障礙、呼吸困難、結膜炎、頭痛(參考自Merck Index 12th Edition)。
固定液的配置
Karnovsky’s fixative
1. 2g粉狀聚甲醛(paraformaldehyde)溶於25ml水中,加熱至 60~70℃,加1~3滴1N的NaOH,攪拌至溶液澄清為止。
2. 冷卻後,加入50%戊二醛(glutaraldehyde)5 ml,以0.2M pH 7.4~7.6之二甲次砷酸鹽(cacodylate)或磷酸鹽(phosphate)緩衝溶液(註2)加至50ml,使pH值為7.2。
(註2) 緩衝溶液(Buffer Solutions):一般在進行固定時,除了調配固定液之外,尚需添加「緩衝溶液」。Palade的研究指出(Ruzin, 1999),組織在被固定的過程中,其周圍的其他組織與固定液會轉變為酸性,為了控制固定過程中的酸鹼值以維持蛋白質與固定液的產生交鏈作用,所以必須添加緩衝溶液。
緩衝溶液配置
0.2M cacodylate buffer:42.8 g之二甲次酸鈉溶於1公升水中,並以濃鹽酸調至pH7.4
phosphate buffer
原液
(1) 0.2M之monobasic sodiumphosphate溶液(加27.8g溶於1公升水中)---------- A液
(2) 0.2M之dibasic sodiumphosphate溶液(加53.65g之Na2HPO4‧7H2O溶於1公升水中或71.7g之Na2HPO4‧12H2O溶於1公升水中)-------------------------------------- B液
(3) x ml之A液加上y ml 之B液,然後加水稀釋至200 ml。
切片:
SEM所需之木材樣本可由徒手切片或切片機切片製備,但根據過去研究指出以徒手切片方式所得切片表面之平整性較切片機所得者來的良好(Exley, Butterfield & Meylan, 1974),且徒手切片僅需購買剃刀片即可,經濟性高。低比重木材幾乎可直接以徒手方式切取而得,而中高比重木材則需軟化後方能以刀片切取。切取時可先用已使用過之刀片修整出大小,需特別注意的是,最後一次修整表面時,則需使用新刀片以45°角切下,且該刀鋒面僅能使用一次。若使用舊刀片則會損害細胞形狀,造成細胞碎裂、變形,或產生刀痕。若觀察目標為木材細胞壁排列或外觀結構,則可在切片後將試樣浸泡於20%次氯酸鈉 (sodium hypochlorite, ClNaO)水溶液中去除細胞質物中的碎屑,可提升電顯相片的品質,但若需要觀察壁孔膜(pit membrane)、穿孔板之維纖維排列等細微構造時則不可使用,以免損壞組織原本之完整性。
脫水與臨界點乾燥:
生物標本都含有水分,若樣本中含有水分,在觀察時,電子束的高電壓會造成水分揮發,揮發的水分除了污染樣本室,有會產生放電現象無法觀察或拍照,且生物樣本在此情況下迅速乾燥,易產生變形。
圖3.CO2的臨界狀態
一般生物樣本脫水乾燥方式包括了空氣乾燥、以有機溶劑取代水進行序列濃度之脫水、冷凍乾燥或是臨界點乾燥。空氣乾燥為最簡易、原始之方法,但與空氣接觸面之細胞卻會因表面張力而產生變形,並不適合。藉由醇類(ethanol)、醚類(ether)、酮類(acetone)、氯仿(chloform)、二噁烷(dioxane)等有機溶劑取代樣本中的水分並藉其低表面張力特性達到脫水效果,最常用的溶劑為乙醇或丙酮,並搭配臨界點乾燥進行。冷凍乾燥則是將標本置於液態氮、液態二氯二氟代甲烷(Freon)、液態丙烷或其他冷煤中迅速冷卻,在低溫高真空的環境下使得標本中的水分氣化而達乾燥。臨界點乾燥(critical point drying, CPD)則是利用液體置換樣本中水分再以氣態方式使水分逸出,不經蒸氣的潛熱或密度變化,因為達成此結果需在特定溫度與壓力下,遂以臨界點稱之,臨界點乾燥的置換液可使用液態二氧化碳、液態氨、hexaflurooacetone、monochlorodifluoromethane(Freon 22)等,一般多用臨界溫度31.0℃、臨界壓力1072 psi的液態CO2進行。
金屬離子覆膜:
SEM是藉由電子束撞擊至樣本後所反射出的二次電子(secondary electrons)呈現出樣本表面的影像,木材為生物樣本,本身並非為導電體,要解決此一方法需再樣本表面鍍上一層導電層,包括金鈀合金、金、鉑、碳等都可做導電層。 覆膜的方法包括真空蒸鍍、噴射覆膜(sputter coating)及熱堆積。
穿透式電顯樣本之製備步驟
樣本一般製備步驟包括:軟化(保存)、切取試樣、固定、脫水、包埋(Embedding)、超薄切片、染色,自軟化至脫水等程序,皆與SEM之處理步驟相同。
包埋(Embedding):
「固定」的目的在於殺死並維持生物組織或細胞的真實與完整,以固定液處理生物細胞後,可以防止細胞在乾燥或其他處理時產生的收縮或膨脹變形、組織或胞器的溶解或其他非自然生成的現象(如細胞表面形成粒狀物質或形成平滑表面等),除此之外,部分固定液甚至可促進染色劑與組織的結合。
此步驟是為了要保存木材中組織以避免在後續處理過程中流失或破壞,由於木材樣本對液體的滲透性較其他植物組織而慢,所以固定時間可斟酌延長,浸泡於固定液中時,不時搖晃樣本瓶以加速促進固定液的滲透。
Spurr’s Epon
Spurr氏所製備之環氧樹脂(Epoxy resin)具有電子透明性、室溫下黏性低、滲透力強與熱度穩定性,以上特性可提高樣本在電子束下的對比、使得樣本能充分吸收樹脂,減少因滲透不良而造成超薄切片的破碎、增強切片在電子束下之穩定性。又Spurr’s樹脂能耐KMnO4之氧化,適合KMnO4染色時使用。其組成份包括主劑ERL 4206 (vinyl cyclohexene dioxide)、硬化劑NSA (nonenyl succnic anhydride)、塑性劑DER 736 (diglycidyl ether of propylene glycol)、加速劑 DMAE (dimethylaminoethanol)。
Spurr(1969)建議的配置比例
切片:
粗切
粗切時以玻璃刀(glass knife)進行,使用手製玻璃刀之玻璃板需為良質玻璃,5~6mm厚,以肥皂水洗淨後風乾。以玻璃刀製造器(knife maker)製備成三角塊狀之玻璃刀。
玻璃刀之刀口角(a)在45~55°之間較為適宜,試料與包埋劑的硬度不同所需的刀口角亦不同,若木材試塊之比重較高或使用硬度高的Spurr樹脂時,刀口角宜大。理想上,玻璃刀的刀口應成直線,但不太可能成功,通常刀口右側會向上彎曲,不適合使用,又每支玻璃刀製作出來的形狀不盡相同,應選擇適用部位進行切片。玻璃刀製造後應盡快使用,以減少因空氣氧化而蝕損刀口,不用時應儲存於乾燥器中。
細切
細切是以鑽石刀(diamond knife)進行,適用於生物材料之鑽石刀刀口角以45~55°為宜,其掏角(clearance angle)不宜過大,因依照製造商之建議,切取木材試樣可使用4°。使用前後發現刀口有異物附著時,可使用軟木棒、木栓片或專用之清潔棒(knife clean stick)沾100%乙醇與刀口縣平行擦拭。
染色:
染色為增強影像對比度最有效的方法,可分為正染色(positive staining)與負染色(negative staining)兩種。正染色是使重金屬染劑直接與物體的構成分子結合,負染色則是使染劑沉積於物體的外圍,二者均能造成電子散射的效果以提高對比度,唯影像黑白對比正好相反。染色的原理是讓一些電子散射能力較強的金屬與生物樣品中特定的分子結合,使其呈現較好之對比度。最常作為染劑的金屬有鈾(U)和鉛(Pb),其他如鋨(Os)、銀(Ag)、鐵(Fe)、金(Au)等也常視樣品種類而為染劑。一般的切片染色常以醋酸鈾醯(uranyl acetate)及檸檬酸鉛(lead citrate)作雙重染色(double staining),醋酸鈾醯能使蛋白質與核酸染色,檸檬酸鉛則可使經過四氧化鋨固定後的胞膜構造更為清楚。
TEM樣本製備程序時間表
1. Karnovsky’s固定液固定-----------------------------------------------------------------2 hr.
2. 緩衝溶液沖洗-------------------------------------------------------------------------------3 hr. (至少換新6次)
3. OsO4後固定(1-4℃)----------------------------------------------------------------------1~2 hr.
4. 緩衝溶液沖洗-------------------------------------------------------------------------------3 hr. (至少換新5次)
5. 50% 酒精脫水------------------------------------------------------------------------------15 min.
6. 70% 酒精脫水------------------------------------------------------------------------------15 min.
7.70% 酒精 + 2%醋酸鈾醯(uranium acetate)溶液,混合比1:1------------20 min.
8. 95% 酒精脫水------------------------------------------------------------------------------15 min. (2次)
9. 100% 酒精脫水-----------------------------------------------------------------------------10 min. (2次)
10. 100% 丙酮----------------------------------------------------------------------------------10 min. (2次)
11. 丙酮 / Spurr樹脂 混合比1:1,抽氣30 min.,旋轉15 min.
12. 丙酮 / Spurr樹脂 混合比1:2,抽氣30 min.,旋轉15 min.
13. Spurr樹脂,抽氣30 min.,旋轉1.5 hr.
14. Spurr樹脂,抽氣30 min.,旋轉1.5 hr.
15.包埋(包埋前1~2hr.先將空的膠囊或成型盤烘乾以70℃乾燥90min.,取出靜置30min.待冷)
16.將包埋的樹脂塊以70℃烘箱加熱48hr.
17.銅網片(grid)覆膜
18.玻璃刀粗切組織塊,厚度0.5μ~1.0μ,以光顯先行檢查
19.鑽石刀細切超薄片組織塊,厚度70nm
20.使用已覆膜之銅網片撈取超薄切片
21.2%高錳酸鉀(KMnO4)染色
http://www.hla.hlc.edu.tw/hlawww/dept04/woodscience/structure_and_properties/em_spemicen_preparation.htm