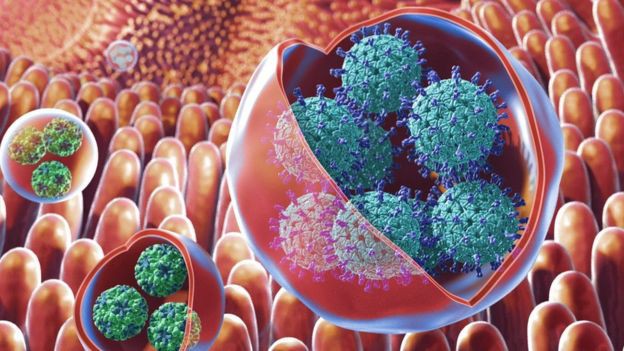
※病毒竟會形成“病毒球”,神不知鬼不覺地感染人體※
來源:新浪科技2018年08月15日 08:27
新浪科技訊 北京時間8月15日消息,據國外媒體報導,科學家近日發現,病毒會形成鬼鬼祟祟的“病毒球”,增加自己感染宿主的幾率。
人們過去認為病毒在感染宿主時都是“孤狼作戰”。但實際上,它們可以構成由40個病毒構成的“大軍”,並用“脂肪球”將自己包裹起來,躲過宿主身體防禦系統的實現。美國國立衛生研究院的研究團隊稱,他們的這一發現將改寫感染學教科書。
研究人員是在分析感染了輪狀病毒或諾如病毒的患者糞便樣本時做出這一發現的。輪狀病毒是引發兒童腹瀉的首要原因。諾如病毒更是有著極強的傳染能力,在學校、護理中心和遊輪上十分猖獗。
“這一發現令我十分震驚。”美國國立心肺血液研究所宿主-病原體關係研究組帶頭人妮哈爾·阿爾坦·邦奈(Dr Nihal Altan-Bonnet)表示,“這與我之前相信的理論背道而馳……我在糞便樣本中觀察到這一現象時,簡直不敢相信自己的眼睛。我無法相信它們可以這樣存在。”
傳統觀點認為,一個病毒會感染一個細胞,然後將其轉化為“病毒製造工廠”,最終細胞破裂,造出的病毒一個一個流出細胞、進入體內。但事實上,有些病毒會構成囊泡,以“小團體”的形式流出細胞。
實驗顯示,這些“病毒球”有著巨大優勢。它們就像穿了隱形衣一樣,可以躲過免疫系統的法眼。還可以保護病毒不受胃酸等嚴苛環境的侵害。此外,它們還能幫助病毒大批量到達目標感染點,使腸道細胞不堪重負。
研究人員用兩種不同形式的病毒對動物做了感染測試,一組為單個病毒,另一組則是聚集成球的病毒。阿爾坦·邦奈表示:“感染了病毒囊泡的動物發病更快,症狀也更嚴重。我們認為,躲在囊泡中的病毒能夠躲過免疫系統的追殺,而且要花更長時間才能清除。在病毒世界中,只要躲在囊泡裏,在感染時就能搶佔先鋒。”

新療法?
目前輪狀病毒和諾如病毒都沒有藥物治療手段,因此研究人員希望,將囊泡作為打擊物件可幫助我們找到新療法,如使囊泡破裂分解,或在一開始阻止囊泡的形成。
阿爾坦·邦奈博士指出,尋找諾如病毒等疾病療法的重要性不容低估。“就連像你我這樣的健康人也可能得病,好多天都不能上班。患者會飽受嘔吐、腹瀉之苦,還要花大量醫療費。對兒童和老人還有可能致命。”
研究人員稱,脊髓灰質炎病毒和感冒的常見病原體鼻病毒也可以構成這種鬼鬼祟祟的“病毒球”。
諾丁漢大學病毒學教授喬納森·鮑爾(Jonathan Ball)表示,此次發現令他們驚訝不已:“與孤軍作戰、毫無保護的病毒相比,這些囊泡似乎增加了病毒的感染能力。我們還不清楚為何病毒聚集到一起就能增加其威力,這無疑將是下一個研究重點。但這些資料確實說明,我們對病毒生命週期中的一些關鍵環節還所知甚少。”
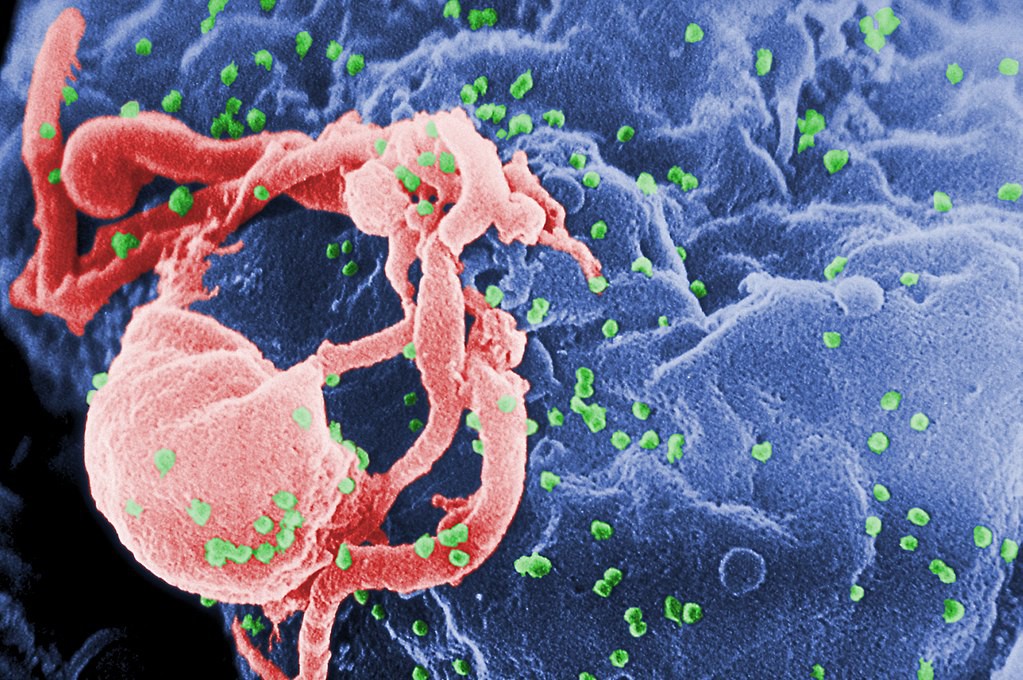
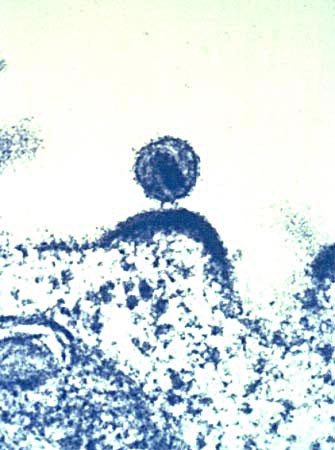
人類免疫缺陷病毒(英語:human immunodeficiency virus,縮寫為HIV)是一種感染人類免疫系統細胞的慢病毒,屬逆轉錄病毒的一種。普遍認為,人類免疫缺陷病毒的感染導致愛滋病,愛滋病是後天性細胞免疫功能出現缺陷而導致嚴重隨機感染及/或繼發腫瘤並致命的一種疾病。愛滋病毒起源於1920年代的非洲金沙薩,自1981年在美國被識別並發展為全球大流行。人類免疫缺陷病毒通常也俗稱為“愛滋病病毒”或“愛滋病毒”。
人類免疫缺陷病毒作為逆轉錄病毒,在感染後會整合入宿主細胞的基因組中,而目前的抗病毒治療並不能將病毒根除。世界衛生組織(WHO)在2016年估計全球約有3670萬名愛滋病毒感染者,流行狀況最為嚴重的仍是撒哈拉以南非洲,其次是南亞與東南亞,成長幅度最快的地區是東亞、東歐及中亞。
在人類免疫缺陷病毒感染病程的一些時期,特別是早期及末期,具有感染性的病毒顆粒會存在於含有免疫細胞、血漿、淋巴液或組織液的某些體液中,如血液、精液、 前列腺液、陰道分泌液、乳汁或傷口分泌液;另一方面,病毒在體外環境中極不穩定。因此,人類免疫缺陷病毒的傳播途徑主要是不安全的性接觸、靜脈注射、輸血、分娩、哺乳等;而通常的工作、學習、社交、或家庭接觸,比如完整皮膚間的接觸、共用坐便器、接觸汗液等,不會傳播人類免疫缺陷病毒;與唾液或淚液的通常接觸(如社交吻禮或短暫接吻)也未有導致傳播人類免疫缺陷病毒的報告;但美國疾病控制與預防中心說已感染病毒的母親,可能將病毒透過先嚼過的食物(唾液內含血液)傳給孩子。
起源
病毒最早出現在1920年代的非洲金沙薩,由非洲中西部的黑猩猩傳給人類,後來愛滋病毒由此處開始蔓延全球。
發現
愛滋病最早是於1980年代初期在美國被識別,早期的病人都是年輕的男同性戀者,因此愛滋病一度被稱作同性戀病,受到當時雷根保守政府的忽視。但在美國疾病控制與預防中心以及有識的醫生與科學家的持續工作下,累積了信服性的流行病學資料,顯示愛滋病有一定的傳染性致因,同時,因輸血導致非同性戀者罹患病的病例逐漸增多,許多科學家開始調查此傳染性病原。
在巴黎巴斯德研究所專門研究逆轉錄病毒與癌症關係的法國病毒學家呂克·蒙塔尼及其研究組於1983年首次從一位罹患晚期卡波西氏肉瘤的年輕男同性戀愛滋病人(首字縮寫LAI)的血液及淋巴結樣品中,分離到一種的新的逆轉錄病毒;他們發現這種病毒不同於人類T細胞白血病病毒,而是一種慢病毒,他們將之命名為“免疫缺陷相關病毒”(Immune Deficiency-Associated Virus, IDAV)。大西洋另一邊,蒙塔尼埃當時的合作者,美國國家癌症研究所的美國生物醫學科學家羅伯特·加羅(Robert Gallo)及屬下也從一些細胞株系中分離到新病毒,並將之命名為“IIIB/H9型人類T細胞白血病病毒”(Human T cell Leukemia Virus-IIIB/H9, HTLV-IIIB/H9);加羅小組首次於1984年在《科學》期刊發表論文,論證了這種新病毒與愛滋病的病原關係。
隨後加羅前往法國,提供HTLV-IIIB/H9以與蒙塔尼埃的IDAV (LAI)比較,結果兩株病毒是完全一樣的。本來雙方約定共同舉行新聞發佈會,但已經知情的美國健康與人類服務部(DHHS)部長瑪格理特·海克勒(Margaret Heckler)緊急電召加羅回國,單方面舉行了新聞發佈會。DHHS指示加羅盡速開發在血液中檢測人類免疫缺陷病毒的技術並申請專利,以方便美國的制藥公司在全球銷售這一技術,加羅使用了這種HTLV-IIIB/H9病毒。法美兩國以及雙方的科學家為此有若干年的爭議與官司,一直無解;持續到1991年,雙方才達成某些程度的諒解。
1986年,該病毒的名稱被統一為“人類免疫缺陷病毒”(Human Immunodeficiency Virus, HIV),以更明確的反映出病毒導致免疫缺陷而不是導致癌症的性質。
全球大流行
根據世界衛生組織的HIV/AIDS統計報告,在2004年,全球估計有四千萬人(3590至4430萬人)與人類免疫缺陷病毒相伴生存(被感染),其中五百萬人(430至640萬人)屬於新發感染病例,另外,有三百萬人(280至350萬人)死於愛滋病。這些數字並在不斷增長中,其中,東亞、東歐、中亞等地區漲幅最快。感染最嚴重的地區仍然是撒哈拉以南非洲,其次是南亞與東南亞。
生物學
人類免疫缺陷病毒(HIV)屬於慢病毒屬,是一種潛伏期極長的逆轉錄病毒。HIV分為兩型:HIV-1與HIV-2。多數國家的HIV感染是由HIV-1造成的,並且感染HIV-1後超過90%的患者會在10-12年內發病成為愛滋病;HIV-2主要分佈在西部非洲,其感染往往沒有相關的病症。
演化史
HIV-1與HIV-2兩者都來自非洲中西部,並從靈長類動物傳到人類。HIV-1可能是從黑猩猩的猴免疫缺陷病毒跨種感染演化而來;HIV-2則可能是從幾內亞比紹的烏白眉猴(Sooty Mangabey, Cercocebus atys)的另一種猴免疫缺陷病毒跨種感染而來。
結構
人類免疫缺陷病毒直徑約120納米,呈二十面體。病毒外膜是磷脂雙分子層,來自宿主細胞,並嵌有病毒的蛋白gp120與gp41;gp41是跨膜蛋白,gp120位於表面,並與gp41通過非共價作用結合。向內是由蛋白p17形成的球形基質(Matrix),以及蛋白p24形成的半錐形衣殼(Capsid),衣殼在電鏡下呈高電子密度。衣殼內含有病毒的RNA基因組、酶(逆轉錄酶、整合酶、蛋白酶)以及其他來自宿主細胞的成分(如tRNAlys3,作為逆轉錄的引物)。
基因組及其表達與調控
病毒基因組是兩條相同的正股RNA,每條RNA長約9.2-9.8kb。兩端是長末端重複序列(long terminal repeats, LTR),含順式調控序列,控制前病毒的表達。已證明在LTR有啟動子和增強子並含負調控區。LTR之間的序列編碼了至少9個蛋白,可分為三類:結構蛋白、調控蛋白、輔助蛋白。
<1>結構蛋白
<A>Gag
gag基因產生55kD的蛋白p55。p55由病毒編碼的一個蛋白酶切成四個小蛋白:MA(p17基質)、CA(p24衣殼)、NC(p9核衣殼)、及p6。
<B>Pol
Gag-Pol融合蛋白是經過mRNA上一個順式調控模件(cis-acting motif)導致的核糖體移位(frame shifting)事件產生,使得pol基因的閱讀框(reading frame)被使用。這種情況發生的機率是5%,所以,Gag與Gag-Pol產物的比率維持在20:1。融合蛋白由病毒編碼的一個蛋白酶切為四個小蛋白:Pro(p10蛋白酶)、RT(p50逆轉錄酶)、RNase H(p15 RNA酶H)、及IN(p31整合酶)。
<C>Env
Env起先是160kD的蛋白,在高爾基體中經糖基化,在天冬醯胺上被加上25至30個複雜的N連糖鏈,成為gp160;這個糖基化過程對感染性是必要的。之後,宿主細胞的一個蛋白酶將gp160切為gp41與gp120。
<2>調控蛋白
Tat
Tat是一抗終止蛋白,可以促使HIV的基因呈有效表達,它作用機制是使RNA-pol II在經過轉錄終止點的時候能夠繼續轉錄,避免HIV基因組過早的停止轉錄過程。
生活史
人類免疫缺陷病毒感染多種細胞,包括CD4陽性輔助T細胞與巨噬細胞等在表面表達CD4分子的細胞。病毒進入輔助T細胞或巨噬細胞不僅僅是透過病毒顆粒被膜的糖蛋白gp120與被感染細胞的CD4分子之間的相互作用來介導,而是同時需要宿主細胞表面的趨化因數受體來作為協同受體。嗜M(巨噬細胞)型(macrophage (M)-tropic)人類免疫缺陷病毒(或稱做“非合胞誘導型株”,non-syncitia-inducing strains, NSI)利用乙類趨化因數(beta-chemokine)受體CCR5進入細胞,因而可以在巨噬細胞與CD4陽性輔助T細胞中複製。嗜T型(T cell (T)-tropic)人類免疫缺陷病毒(或稱做“合胞誘導型株”,syncitia-inducing strains, SI)使用甲種趨化因數(alpha-chemokine)受體,因為主要在CD4陽性輔助T細胞中複製,儘管也可以在巨噬細胞中複製。僅使用CCR5受體進入細胞的病毒,稱為R5;僅使用CXCR4受體的,稱為X4;兩者都使用的,則稱為X4R5。當然根據協同受體分型並不一定區分病毒的實際細胞嗜性。
人類免疫缺陷病毒也可感染樹狀細胞。
糖蛋白gp120與其協同受體及CD4分子的相互作用,引發gp120蛋白構象的改變,從而將跨膜糖蛋白gp41原本深埋的部分曝露,進而使gp120的V3環接近協同受體,然後gp41導致病毒被膜與靶細胞膜的融合,使病毒核衣殼進入細胞。gp41導致細胞膜融合的具體機制仍未明瞭。
有些人群對HIV有較高的抵抗力(但並不是完全抵抗),是因為他們的細胞缺少HIV進入細胞的一個協同受體(co-receptor),這個協同受體是趨化因數受體CCR5。他們的CCR5基因有一段長為32堿基對的缺失(deletion),造成產物蛋白嚴重截斷(truncated),不能在細胞表面探測到。這些人主要分佈在歐洲,也有分佈在中東及印度次大陸。
HIV作為病毒,必須進入細胞才能繼續其生活史(整合、複製、釋出…)及感染史。病毒透過其表面的gp120糖蛋白與靶細胞表面的細胞分化抗原(或稱分化簇)CD4分子作用,與靶細胞的細胞膜融合並進入細胞。這個過程需要靶細胞表面的一個七次跨膜的G蛋白耦聯受體,目前發現的主要為趨化因數受體CCR5(嗜M的病毒株)及CXCR4(嗜T的病毒株)。
具有該CCR5缺失的人,因為細胞表面不表達CCR5,使部分HIV不能進入並感染這類細胞。但HIV可以透過其他協同受體感染這類細胞,或者其他類型的細胞不需要此CCR5就可以被感染,所以這些人並不能完全抵抗HIV。事實上,已有該CCR5缺失的純合個體感染HIV的病例報告。
病毒核衣殼一旦進入細胞,病毒的逆轉錄酶就將病毒的單鏈正意RNA從病毒蛋白上釋放,並根據正意RNA逆轉錄生成反意互補DNA(cDNA)。這個逆轉錄過程非常容易出錯,因此這是病毒進行突變(如,獲得抗藥性)的重要步驟。然後,根據cDNA合成雙鏈的病毒DNA(vDNA)。新的病毒DNA被轉運到細胞核中,並由病毒的整合酶將其整合到宿主的基因組上。這樣,病毒完成感染開始進入潛伏期。
要啟動病毒,細胞中需要存在一些轉錄因數。最重要的一種叫做NF-κB,存在於所有被啟動的T細胞中。這就意味著,最容易被人類免疫缺陷病毒殺死的細胞,恰恰是那些正在參與感染作戰的細胞。
致病機理
HIV選擇性地侵犯帶有CD4分子的細胞,主要有T4淋巴細胞、單核巨噬細胞、樹突狀細胞等。細胞表面CD4分子是HIV受體,透過HIV囊膜蛋白gp120與細胞膜上CD4結合後由gp41介導使毒穿入易感細胞內,造成細胞破壞。
gp120是HIV病毒的衣殼蛋白,由基因env編碼,其分子量為120KD。在病毒侵入人體T細胞的過程中發揮重要的作用,同時它還存在游離態的形式,透過一種類似於超抗原作用的途徑,在體內非特異性地啟動一些主要的免疫細胞,從而大大增強了HIV對人體的危害作用。
在HIV侵入人體的過程中,表達在病毒表面的gp120使HIV病毒輕易地結合於特定的T淋巴細胞上,然後透過病毒蛋白外殼與T細胞膜的融合,從而達到浸染T細胞的目的。此外,游離於體內的gp120透過其特殊的超抗原作用啟動過量的T細胞,並且刺激體內其他免疫細胞發生一系列反應,大大降低了人體的免疫功能。現在有關gp120的研究正逐步深入,可以預見在不久的將來gp120會成為AIDS免疫治療中的靶分子。
愛滋病病毒難以對付的原因有幾個。第一,愛滋病病毒是一種RNA病毒,它會使用逆轉錄酶把RNA整合到細胞的DNA中。在此之間,它有大量突變的機會。因此,病毒很快會對療法產生抵抗力。第二,通常認為的愛滋病病毒是T細胞殺手的想法是不正確的。如果愛滋病病毒是殺手病毒的話,它很快就會死亡,因為沒有更多的時間感染新的感染者。通常,愛滋病病毒都會在人體存活數年,在病人不知情的情況下透過性行為或血液交換進行傳播。它把自己整合在寄主細胞的DNA中,保持數年的休眠狀態,免疫系統不會對其作出反應,因為它只是DNA片段。當細胞分裂和複製的時候,病毒被一起複製。數年後,病毒會變得活躍起來,奪取對細胞的控制和開始複製。在近幾年,那種CD4+ T細胞是直接由於HIV感染而減少的觀念也受到質疑。愛滋病病毒的蛋白質糖衣受到病毒微粒的驅動,使得血液中充滿這些蛋白質,它會粘住CD4+ T細胞,把它們黏合在一起。另一方面,這些細胞被免疫系統識別,並引起免疫反應,使得免疫系統殺死自己的CD4+ T細胞。
醫學
傳播
愛滋病毒是透過交換體液來傳播的,特別是精液和血液。
最常見的傳染途徑是:進行陰道或肛門性交,共用沾汙了的針筒,受病毒感染的母親傳播給嬰兒。
另外,亦有越來越多個案顯示,感染了病毒的母親可經喂母乳而把病毒傳給嬰兒。
途徑
任何帶有足量病毒的體液交換。
預防
正確的避孕套可大幅降低感染HIV的機率,但亦非天衣無縫。
暴露愛滋病毒“後”預防性投藥( Post-Exposure Prophylaxis, PEP):暴露於感染風險後(如發生危險性行為、針紮或其他血液體液交換接觸),72小時內服用抗愛滋病毒藥物(每次療程28天)可有效降低愛滋病毒感染機率。
治療作為預防(Treatment as Prevention):已感染者服用愛滋病藥物對預防傳播的效果極佳,血清相異伴侶中之血清陽性一方可經由穩定服藥,避免將病毒傳染給陰性之一方。
暴露愛滋病毒“前”預防性投藥( Pre-Exposure Prophylaxis, PrEP):于暴露愛滋病毒之風險行為前使用抗愛滋病毒藥物也可大幅減少服用期間的感染機率。目前針對PrEP的藥物,僅有舒發泰一款,分為每日服用(daily)或依據事件驅動使用(event-driven)。針對愛滋病毒血清相異伴侶而言,陰性之一方若每日服用,其避免感染愛滋病毒的效果可達100%。
體征與症狀
通常是發生伺機性感染的疾病,如卡波西氏肉瘤、肺囊蟲肺炎,才被發現。此外還會出現體重急遽減輕。持續發燒。淋巴腺腫大等症狀。會入侵人類免疫細胞並加以破壞。
實驗室診斷
實驗室檢驗人類免疫缺陷病毒感染主要分成兩階段, 第一階為篩檢法,利用酵素免疫法(Enzyme immunoassay, EIA)、微粒凝集法(Paraticle agglutination)或快速篩檢法(Rapid test)做初步檢測,因偽陽性率甚高,因此若篩檢為陽性時應再以第二階段的確認試驗做確診,確認試驗主要有西方墨點法(Western blot)、核酸分析法(Nucleic Acid Testing, NAT)和p24抗原中和試驗(Neutralization test)。
其中,酵素免疫法(Enzyme immunoassay, EIA)目前已發展到能同時檢測抗體和病毒p24抗原的第四代檢驗試藥,即疾病管制署所稱的艾滋抗原/抗體複合型檢測(HIV antibody and antigen combination assay)篩檢,能大幅縮短空窗期至一到二星期,在臺灣,使用複合型檢驗法的實驗室於2012年已經達56.3%之多。
若非使用艾滋抗原/抗體複合型檢測法來檢驗是否感染愛滋病毒,則需等到抗體產生後才能經由篩檢法驗出,感染至抗體產生的期間稱作空窗期,平均約是二到八周,0.1%以下比例的少數人會大於這個時間,目前國際間的共識約是十二周。
或是可以使用RT-PCR等方式檢測血中是否帶有病毒的RNA/DNA作為診斷,此方法的空窗期約七至十四天,一般建議為二十八天。但是費用較為昂貴。
治療
今天病人通過服用不同的藥物攻擊在不同的階段愛滋病病毒。這些藥物包括:
1>抑制蛋白酶抑制愛滋病病毒活動所需要的蛋白酶的活動。通常也可以用來抑制複製活動。如Saquinavir, Indinavir, Ritonavir, Kaletra, Nelfinavir等藥物。
2>抑制逆轉錄酶(reverse transcriptase inhibitors,RTIs)抑制逆轉錄酶的活動。逆轉錄酶是愛滋病病毒用於複製的酶,缺乏這種酶可以阻止愛滋病病毒建立RNA和DNA。它有三種形式:
3>非核苷酸反轉錄酶抑制劑如Nevirapine, Efavirenz等藥物
4>核苷酸反轉錄酶抑制劑如齊多夫定(AZT), 司它夫定Stavudine(d4T), Didanosine(ddI), Zalcitabine(ddC), 拉米夫定3TC), Abacavir(AZT+3TC)
5>抑制進入的藥物抑制愛滋病通過溶解寄主細胞的膜進入細胞內。
建立對HIV療法的課題面臨很多困難。每一種有效的藥物都有副作用,通常是嚴重的或是致命的。常見的副作用包括嚴重的噁心、腹瀉、肝臟的損毀和衰竭、黃疸、高血脂、糖尿病、脂肪組織移位元、貧血、腎結石。致命的副作用包含史蒂芬斯-強森綜合征、猛暴性肝炎、胰臟炎、乳酸血症。每一種療法都要求經常性的血液檢查以確定療效和肝臟功能。
預斷
如果不進行治療,根據HIV不同亞型,感染愛滋病毒後的的淨存活時間平均為9至11年,而診斷為AIDS之後,如果在資源受限導致無法治療的情況下,根據不同的研究表明,平均存活時間在6至19個月之間。而在醫療資源充足的地區,用高效抗逆轉錄藥物(HAART)的作為有效治療手段治療HIV感染者和AIDS患者,可以讓死亡率減少80%,並能將新診斷出的HIV感染者的壽命延長最少30年。
隨著新的治療辦法不斷被研發出來,並且由於HIV持續演化出對這些藥物的抗性,對於存活時間的估計可能繼續改變。如果沒有抗逆轉錄療法,患者通常在病情診斷為已發展成AIDS後1年死亡。大多數患者因為免疫系統的持續失效而死於機會性感染或者惡性腫瘤。臨床疾病的發病率因為個體的不同而呈現巨大差異,已有研究表明其受許多因素的影響,例如宿主的易感染性和免疫功能,保健措施和交叉感染,以及特定病毒品種的影響。
HIV與愛滋病的差異
雖然HIV與愛滋病(Acquired Immune Deficiency Syndrome, 簡稱AIDS,又稱獲得性免疫缺陷綜合征)常一起提到,但是兩者是不同的概念。簡單來說,HIV指的是“病毒”,但是愛滋病指的是因免疫系統能力下降而出現的“感染”, HIV感染者不會馬上發病,而是要呈現發病的狀況才會稱為愛滋病。
愛滋病重估運動(AIDS reappraisal movement ,或愛滋病異見組織,AIDS dissident movement)是一個由活躍分子、記者、市民、科學家、研究人員和醫生組成的鬆散組織,他們對認為人體免疫缺陷病毒(HIV)是導致獲得性免疫缺陷綜合征(愛滋病)的主流一致意見持否認、質疑的態度。
對愛滋病的質疑
他們以很多形式提出質疑,可以大致表述如下:
1>HIV不存在;
2>HIV是一種無害的逆轉錄酶病毒;
3>HIV確實存在,並可能引起愛滋病,但是沒有證實;
4>HIV確實存在,但是不會引起愛滋病:是其他的因素引發愛滋病的;
5>HIV確實存在,但是不會引起愛滋病:愛滋病不是傳染病;
6>HIV確實存在,但是不會引起愛滋病:是其他的傳染因素和非傳染因素共同作用引起愛滋病的;
7>HIV確實存在,並可能引起愛滋病,但是必須與其他因素相互作用;
8>愛滋病是由愛滋病藥物引起的;
9>愛滋病不存在;
10>愛滋病不過是由腐敗的藥物公司、科學家和醫生提出的騙人的幌子;
這些聲明通常受到並引發來自很多科學社區的抵制、挑戰和敵意,他們把愛滋病否認主義人士稱為是不顧有關HIV在愛滋病中起作用的證據,並以一種不負責任的態度通過他們的持續活動威脅公共衛生。否認主義者則認為當前基於HIV的治療愛滋病的方法只會導致不精確的診斷、心理恐懼、毒性治療以及一系列的公共資源的浪費。這場源於1980年代並持續到現在的爭論已經引起了雙方相互的敵對情緒。
文章定位:



