每日水素?
引自 http://mulicia.pixnet.net/blog/post/24606417-每日水素?
最近廣告中,出現了一個奇怪的東西,叫做每日水素
水素,是日文的氫,就像常聽到的酸素,是日文的氧一樣。
但是,拿氫來吃?是一件很奇怪的事情,所以我查了一下文獻
發現,有一位日本人:及川胤昭所發開的負氫離子?
這東西真稀奇,大家都知道H是氫在元素週期表的代號,H+是他的離子態,那H-呢?
如果你看他產品的描述,就會覺得更神奇了,我簡單貼一小段:
以最尖端的
離子柵格貯存技術,將負氫離子,以穩定的固體狀態集存
於珊瑚鈣中將大自然介中最難補捉到的健康負氫離子吸藏
成細微粉末食品,可以幫助細胞抗氧化功能。
有鑑於此,讓我們先來解釋一下元素的電子型態:
如果高中是自然組的,一定知道化學有教過八隅體理論(Octet rule),當然,路意士有很多學說後來也証實有錯,八隅體理論也只是通則,不算是定律,但是今天用來來解釋比較簡單易懂。
八隅體規則指出各個原子趨向組合成每一個價層都擁有八個電子,與惰性氣體擁有相同的電子排列。主族元素,如碳、氮、氧、鹵素族、鈉、鎂都依從這個規則。簡單而言,當組成離子或分子的組成原子的最外電子層有八個電子,它們便會趨向穩定。
第一層電子最多有2個,第二層8個,第三層8個,第四層18個。
簡單舉例:
你常見的氫,其實是一個正電的核,加上一個電子在他的外圈,氫原子本身不具有中子(他的同位素就有)
所以畫起來是這樣:

但是如果今天他的電子離家出走了,我們就會將他寫成
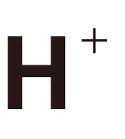
因為他只剩下一個正電的核了
而時候的氫,會很需要一個電子回來,讓他形成穩定態,所以我們可以說,這時候的氫比較不穩定。
接著,有另外一個東西你也一定很熟,就是氧
一般來說,寫做O,他在元素態時,外圈具有6個電子

所以依據八隅體理論來說,他其實需要在補上兩個電子讓他形成穩定態:

所以,你可以直覺的想到,剛剛的氫有一個電子,補上兩個氫給氧,就會形成穩定態了,也就是水

好的,那有負氫離子嗎?
當然是有的,就是在本來的氫原子身上,加上一個電子給他,就形成負氫離子了,或是你要說氫負離子也可以。

記號寫做

但是一般常溫常壓之下,氫多半以氣體方式存在或是於溶液中以酸的形態存在
寫做H2

其他還有一些你常見的東西,像是鹽巴(氯化鈉)
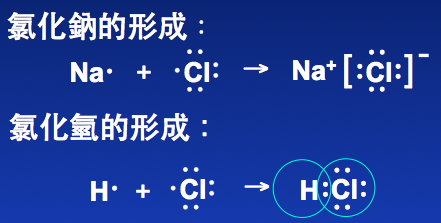
這就是簡單的八隅體理論。
接著回到我們今天要提的這樣產品:每日水素
首先你要知道:直接要將固態氫拿來食用,可行性並不高,所以他才會宣稱是用離子柵格技術保存,
讓我解釋常溫常壓中不存在固態氫的理由給你知道:
首先:氫氣是一種會自燃的物質,不只是太陽會用到,目前也有用他來做引擎,
但是今天不是要拿來焊接或是燒東西,是要拿來吃的,所以我們需要的是固態氫,只是固體的氫需要哪一種條件才可以達成呢?
這時候我們就要叫出曾經出現在高中課本的一個東西:
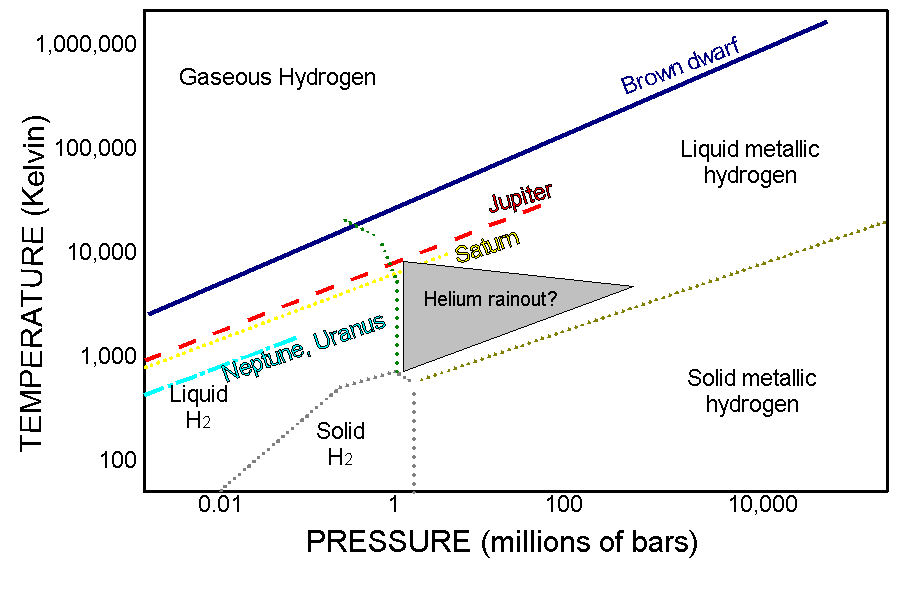
是的,這東西叫做三項圖,你以前可能看過水的,不過今天講的東西是氫,所以我找了氫的給你看
左邊的是凱氏溫標,下面的座標是壓力
如果你對於bar這東西的計算不是很能理解,我可以給你一點提示:
1 bar = 100 kPa (kilopascals) = 1,000,000 dynes per square centimeter (baryes) = 0.987 atm (atmospheres)
所以根據上圖,要維持氫在固態狀況下,需要0.01~1百萬bar,所以就是9870~987000大氣壓,此時溫度是100K,也就是-173度c
有點詭異,所以我又換了一張圖:
結果還是一樣,因此就算再有本事,也不可能將固態的氫在常溫常壓下中保存起來。
姑且先不管氫的形態及保存方式,為何需要補充氫,尤其是氫負離子呢?
根據廠商的說法:氫負離子是最佳的抗氧化劑,所以可以提供身體抵抗自由基的能力。
關於自由基,我們要先了解,化學上基的定義:
“基”(radical)這個名詞在化學中常用來表示不同的原子團,如碳酸基(CO32-)、硝酸基(NO3-)、甲基(CH3-)等。
而所謂自由基就是「帶有一個單獨不成對的電子的原子、分子、或離子,是高反應且半衰期極短的不穩定活性氧化物」。
而當一個或一個以上不配對電子的存在使自由基能受到磁場的吸引,並使它們具有高度活性。
在化學反應中和生物體內有許多自由基(如氫原子等)。
當化合物的共價鍵斷裂時,成對的電子由兩個原子均分,這一過程就稱為均裂(homolytic fission)。
再舉個例子跟大家說明:
A、B是以共價鍵結合的兩個原子(× 代表電子),均裂可表示如下:
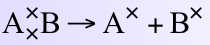
A×是A自由基,以A˙表示,B×是B自由基,以B˙表示。水分子中的一個共價鍵均裂,則生成氫自由基(H˙)和羥自由基(˙OH)。和均裂相反的是異裂(heterolytic fission),當共價鍵異裂時,一個原子接受了成對的電子,如下:
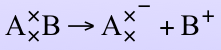
但是如果是A得到一個額外的電子而帶負電荷,B失去一個電子則帶正電荷,例如水的異裂生成H+和OH-,它們分別稱為氫離子和氫氧根離子。它們都不存在不配對的電子,因此不是自由基。
其實日常生活中很多反應的過程,都會形成自由基,像是燃燒,
提到自由基,也順便提一個名詞:活性氧:
活性氧是指氧的某些代謝產物和一些反應的含氧產物,主要有:
(1)氧的單電子還原物如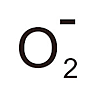 和 O-,以及它們的質子型和HO-;
和 O-,以及它們的質子型和HO-;
(2)氧的雙電子還原物H2O2;
(3)烷烴過氧化物ROOH及其均裂產物RO-,ROO-;
(4)處於激發態的氧,單線態氧和羰基化合物。
活性氧的特點是含有氧,化學性質較氧(基態氧)活潑。
活性氧中有一些是自由基,在這些自由基中,若不配對的電子位於氧,則稱為氧自由基;
活性氧中另一些則是非自由基的含氧物,非自由基的活性氧的特點是可以在自由基反應中產生,同時還可以直接或間接地觸發自由基反應。
從化學的活性來說,氧自由基與活性氧同義,但有例外,如基態氧雖是雙自由基,但其化學活潑性並不強,不屬於活性氧;激發態的分子氧,單線態氧雖不是自由基,但其活性要比雙自由基基態氧和一些氧處於激發態的含氧有基物,如激發態羰基化合物和二氧乙烷,以及臭氧等也都屬於具有生物學意義的活性氧種。
因此嚴格來說:O2和H2O2我們稱之為活性氧,不叫他做氧自由基,而O2-和HO-與RO-,ROO-則稱為自由基。
了解自由基之後,我們要了解抗氧化劑:
抗氧化劑是指能夠抵抗氧化作用的物質,在生物體內則是指能夠中和氧化作用所產生的自由基而使其失去破壞力的物質,也就是抗氧化劑能夠搶奪破壞力強的自由基的電子,而把自己變成較不活躍、破壞力較弱的自由基。
看完上面那一大串之後,希望你對於電子學說及自由基與抗氧化劑有點初步了解,
接著,我們再到一點靈的網頁上面找點資訊:

出現了另外一位科學家的名字:Patrick Flanagan
老實說,我並不認識這個名字,所以再找了一下:
看到很多經銷產品的網頁,有提到他的成就:

感覺好偉大....不過上面寫的那三本期刊,除了醫藥食品期刊還有點參考價值外,其他兩本幾乎都是保健食品的廣告紙
我去Nature及Science和Scientific American等科學期刊中,試著用作者名稱來找Patrick發表過的文獻,結果是一篇也沒有。
至於那個新科學國際協會,根本沒聽說過,但是勉強要說的話,大概指的是這個吧:The International Organization for Science and Technology Education
不過這個學會並沒有頒過什麼獎就是了。
在這邊,我姑且不否定patrick的成就,不過他個人有架設一個銷售產品的網頁就是了:http://www.phisciences.com/
話說回來,既然是這樣厲害的科學家,怎麼在google裡找到的資料,都是在賣營養產品的呢?
另外有些網頁會說他是諾貝爾獎的候選人,一來,諾貝爾獎候選人名單我沒有看過他,二來,既然沒有被選上,提它是候選人的意義也沒有很大就是了。
繼續,我們來討論一下他的成份:光看他的標示,大概就已經違法了,根本沒有提到珊瑚這東西,而珊瑚鈣,簡單的說就是碳酸鈣,以碳酸鈣的晶格穩定度,也不可能在常溫下面將氫以離子狀態保留下來。
所以回歸基本,我們去日本那邊找一下資料好了:
這邊有及川的研究介紹:http://sapuri-sapurai.com/112.html
裡面有解釋如何將氫離子放進珊瑚裡面,不過我覺得這個說法,還需要驗證就是了,不過我也不想去否定及川先生的研究,好歹他也是山形大學的助教授。
這邊是產品的說明:

看上面的說明,確實有提到珊瑚鈣,不過也多了很多東西,像是維他命b群,所以有些人吃下去有效,該不會是維他命b群的效果吧?
但是剛剛我確實有提過氫負離子呀,所以是怎樣一回事呢?
其實氫負離子是存在於氫化物之中,所謂氫化物是一類氫的化合物。嚴格意義上講,氫化物只包含氫同金屬相互結合的化合物,但由於概念的擴大,有時它也包含水、氨和碳氫化合物等物質。
補上一個氫化物的表格給大家看看:
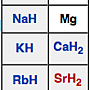
是的,他就存在於週期表的做左邊那一串的物質
氫化物基本上可按以下標準分類:
- 離子型氫化物(類鹽氫化物)
- 一類具有高熔點和較高穩定性的化合物,一般由較活潑的金屬與氫形成,如鹼金屬及部分鹼土金屬和鑭系金屬氫化物。
- 共價型氫化物
- 由非金屬(不含稀有氣體)或類金屬與氫形成,熔點較低,命名上通常叫「某化氫」而非「氫化某」。
- 過渡金屬氫化物
- 為過渡金屬的氫化物,種類很多,其中有些是確定的整比化合物。過渡金屬合金的氫化物是近年來氫化物的研究方向。
- 邊界氫化物
- 性質介於共價型與過渡金屬之間,報導較少。
- 配位氫化物(複合氫化物)
- 包括氫化鋁鋰、硼氫化鈉等,在工業生產及有機合成中具有重要應用。
一句話學的概念,負氫是非常強的還原劑,只是氫負離子不能在水溶液中存在,由於H−離子的生成熱為正值,因此只有電正性大的元素才能與氫形成離子型氫化物。這類化合物在熔融電解時陽極產生氫氣。所有的離子型氫化物都可通過金屬直接與氫氣化合製備,反應溫度為300-700°C。
在生活應用上:
氫化鋰和氫化鈉分別用於複合氫化物LiAlH4、NaBH4及類似化合物的製取。
氫化鈉是有機合成中用途很廣泛的鹼及還原劑。
氫化鈉溶在熔融氫氧化鈉中可作為鋼鐵的脫銹劑。
氫化鈣被用作生氫劑、乾燥劑及工業上還原製備某些單質。
這邊我們找到一個跟每日水素比較相近的產品,就是氫化鈣:
他的結構就是這樣:
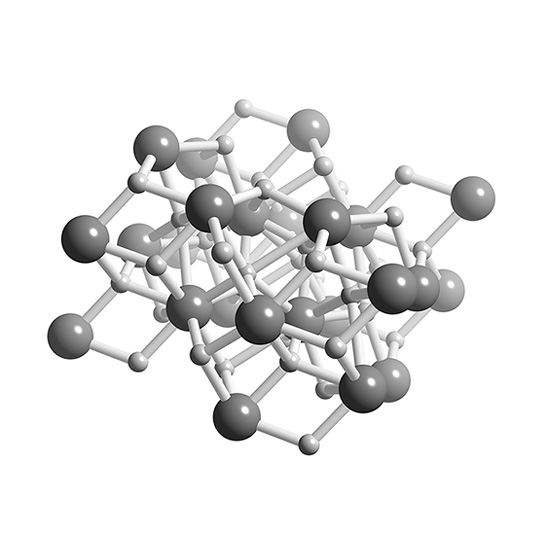
氫化鈣是化學式為CaH2的無機化合物。通常為灰色粉末(高純度時為白色,但很少見),與水劇烈反應產生氫氣。因此CaH2可被用作乾燥劑。
與水反應方程式為:
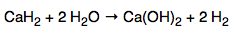
雖然 CaH2 非常方便且常常被選用為乾燥劑,但是它有一些缺點:
- 相較於 LiAlH4,它不溶於任何溶液,因此乾燥反應的速度很慢。
- 因為 CaH2 和 Ca(OH)2 在外觀上幾乎難以區別,CaH2 的樣品純度難以判斷。
- 因為鈣氫化合物不能去除溶解氧,因此它不能用來溶劑去氧。
於是不知道你是否跟我有相同的疑惑:這樣的產品,做成錠劑之後,一定是加水服用,所以服用之後的氫負離子,會從他宣稱的柵格中被釋放出來,並且在身體中呈現穩定狀態,然後快速滲透全身,幫助你清除身體裡面的自由基,尤其是氧自由基?甚至殺死癌細胞?
而且照電子八隅體學說,假設氫負離子為穩定狀態,當他丟出一個電子後,會不會本身也形成一個不穩定的自由基,來攻擊身體呢?
補充一點:
食物中的氧化還原理論是由諾貝爾獎得主Szent提出的,就是那個發現維他命C的人,而他的描述是抗氧化例來自於還原氫,也就是氫原子,並非所謂的氫負離子。
最後,我想要告訴各位的是,也許這個每日水素真的有效果,但是身為一個藥師,對於不明白的東西,我是不建議食用的。
文章定位:




