細胞內的碎紙機-蛋白酶體(Proteasome)
台北市立第一女子中學生物科胡苓芝老師/國立台灣師範大學生命科學系李冠群助理教授責任編輯
蛋白酶體(proteasome)存於真核細胞的細胞核和細胞質中,為溶體(lysosome)外的蛋白水解構造,是細胞調控特定數量蛋白質和除去錯誤摺疊蛋白質的場所。人體每個細胞的細胞核與細胞質中,約含有三萬個蛋白酶體。
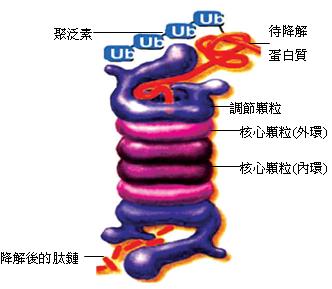
從結構上看,蛋白酶體包括核心顆粒和調節顆粒二部份,均由蛋白質組成(圖1)。
核心顆粒是由多種不同的蛋白質組裝成的中空桶狀複合物,這些蛋白質堆疊成四個環,
- 外側兩環可以發揮「門」的作用,門上的調節顆粒,可以識別連接在蛋白質上的聚泛素(polyubiquitin)標籤,並啟動降解過程,一方面去除泛素,並將泛素釋回細胞質中重複利用;一方面利用水解ATP,釋出能量破壞蛋白質的二三四級結構,並將此解旋後的線型蛋白質注入中空部位。
- 中間兩環內側具蛋白酶活性部位,為切割蛋白質的場所,降解出來的肽鏈由蛋白酶體的另外一端釋放出來。這樣的構造能避免細胞質中的蛋白質誤觸蛋白酶體的活性位置,造成不當的分解。
人體蛋白酶體中的蛋白酶活性主要為三種:
- 類胰凝乳蛋白酶(chymotrypsin)型、
- 類胰蛋白酶(trypsin)型
- 肽-麩胺醯基-水解酶(peptidyl-glutamyl peptide-hydrolyzing)型
它們能在蛋白質的多肽鏈中,
選擇性地從酪胺酸、色胺酸、苯丙胺酸、麩胺酸、天冬胺酸、精胺酸或離胺酸等多種胺基酸的
羧基側進行水解,切斷肽鏈。經過蛋白酶體的降解後,蛋白質一般被切割為約
7-9個胺基酸長度的肽鏈;這些肽鏈可進一步被分解為單一胺基酸
分子,用於
合成新的蛋白質。
有些降解後的肽鏈會在專一性免疫系統運作中扮演著關鍵角色,例如當病毒感染細胞後,屬於病毒的肽鏈抗原會由第一型主要組織相容性複合物(MHC I)呈現於細胞表面,引發細胞免疫。這些肽鏈就是來自感染細胞中入侵的病原體經蛋白酶體降解後的產物。此過程主要是由γ干擾素所誘導,產生一種特殊的調節顆粒參與的作用,可以有效地生成大小和成分均適合的降解片斷以供MHC結合。
- 蛋白酶體僅是執行蛋白質分解的角色,它不能決定那些蛋白質應該銷毀,
- 決定哪一些蛋白質需要貼上銷毀的標籤,是泛素連接酶的工作。
- 這種包括泛素化和蛋白酶體降解的整個系統被稱為「泛素-蛋白酶體系統」(ubiquitin-proteasome system; UPS)。
【參考資料】
諾貝爾獎網站有關蛋白酶體的動畫
http://nobelprize.org/nobel_prizes/chemistry/laureates/2004/animation.html
※資料來源
http://highscope.ch.ntu.edu.tw/wordpress/?p=978
溶體之外-談泛素與蛋白質的降解(Degradation)
台北市立第一女子中學生物科胡苓芝老師/國立台灣師範大學生命科學系李冠群助理教授責任編輯
細胞中的蛋白質擔任多重角色,如管制物質進出、建構細胞形狀、催化反應和運動等,故無論是蛋白質合成或降解 (degradation,也就是指被分解為小片段),都被精確地調控。有關細胞如何調節蛋白質合成的觀念,在目前高中課程多有論述,如中心法則-轉錄或轉譯的過程;原核和真核細胞基因表現的調節;轉錄因子的表現、活化;轉錄後的修飾或是轉譯前後的調節等。其中較為艱深複雜的內容,在經過適當的補述後,常變身為大學入學考試指定考科的閱讀測驗的取材方向,如97年-「轉譯後的修飾和蛋白質活性」;96年-「RNAi的影響」和94年-「轉錄後或轉譯前RNA的修飾」。
相對地,分解蛋白質的觀念則僅在消化生理或是細胞生理時提到,如溶體會經由膜上的質子幫浦維持膜內的酸性環境,分解並回收外源蛋白質以及衰老或損傷的胞器,故與胞內消化、胞器更新和細胞自戕有關。但無論是消化系統中的蛋白酶或是溶體的水解作用,都無法解釋細胞內如何「選擇性」的消除錯誤或廢棄不用的蛋白質,故本單元即以2004化學諾貝爾獎獲獎主題「死亡之吻-泛素」,簡介細胞另一種蛋白質降解途徑,此主題也曾出現2006 國內生物奧林匹亞競賽(IBO)複試B卷中。
以往細胞中的蛋白質分解大多被認為主要依賴溶體,但研究發現細胞內蛋白質的分解過程直接需要能量,而酸性狀態下溶體蛋白酶分解蛋白質是放熱反應,且不具溶體的未成熟紅血球(reticulocyte)也被證實具有需能性的蛋白質降解作用。學者們遂於80年代根據許多研究結果,發展出一套可以細膩解釋蛋白質降解的途徑:泛素-蛋白酶體系統 (ubiquitin-proteasome system; UPS)。
泛素是一種由 76 個胺基酸所組成的小型蛋白質,廣泛存於真核生物和古細菌,故被稱為「ubiquitin」 (源自拉丁文 ubique, everywhere之意)。研究發現在細胞內等待被摧毀的目標蛋白質,會由ATP供給能量,經泛素活化酶(E1)、泛素接合酶(E2)和泛素連接酶(E3)三類酵素先後處理後,將其與泛素鍵結,此一步驟反覆進行,最後目標蛋白質將被接了四個或更多的泛素(圖1),這個短鏈聚泛素分子被諾貝爾頌詞形容為「死亡之吻」。接著,這些被貼上泛素標籤的蛋白質會通過細胞的蛋白酶體,加以分解再循環利用。
聚泛素化是細胞內一種重要的調節過程,經過UPS降解可控制細胞中關鍵信號蛋白和調節蛋白的濃度,同時可以去除過多、受損、折疊錯誤或突變的蛋白質。目前科學家已發現哺乳類細胞含有數種E1、數十種E2以及數百種E3酵素,三類酵素合作,扮演把泛素鍵結到特定蛋白質的角色,尤其是E3酵素的專一性,決定了細胞中要為哪些蛋白質貼上標籤。如果細胞蛋白質的降解出現問題,將會導致疾病,例如人類退化性的神經疾病─帕金森氏症及阿茲海默症的部分成因,便是蛋白質的降解受到阻滯。其它如細胞週期、DNA的修補、抑癌基因(如p53)、細胞凋亡和免疫與發炎反應等,都被發現與此蛋白質降解系統的運作相關。
【想一想】
有學者認為泛素是目前發現演化速度最慢的蛋白質,若此假說為真,你如何解釋?
依照你對生物運作模式的暸解,請推測,聚泛素化後的蛋白質是否有機會死裡逃生呢?
泛素只普遍存於真核生物或古細菌中,那麼真細菌要如何應對蛋白質降解的需求呢?有興趣的同學不妨找找其它資料!
圖1
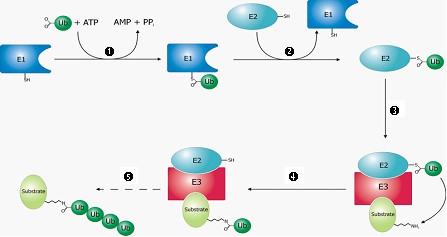
1.經由ATP供給能量,使E1活化泛素(Ub),Ub與E1的cys(半胱胺酸)結合。
2.泛素被轉移到E2。
3.E3可辨認需要摧毀的目標蛋白質(substrate)和E2。
4.經由E2和E3使得泛素轉移到目標蛋白質的lys(離胺酸)上。
5.重複數次,目標蛋白質遂被接上了一短鏈聚泛素。
(圖片來源http://upload.wikimedia.org/wikipedia/commons/7/7f/Ubiquitylation.png)
【參考資料】
蔡蘊明譯2004年諾貝爾化學獎簡介 台大化學系普化課程資訊
http://www.ch.ntu.edu.tw/course/nobel2004.htm
劉宣良等 200年諾貝爾化學獎-蛋白質的死亡之吻 科學發展(393)60-65, 2005
諾貝爾獎網站有關蛋白酶體的動畫
http://nobelprize.org/nobel_prizes/chemistry/laureates/2004/animation.html
※資料來源
http://highscope.ch.ntu.edu.tw/wordpress/?p=989